Enzymketten bewirken den gerichtete Abbau und Aufbau bzw Umbau von Molekülen in der Zelle. Das An- und Abschalten dieser Stoffwechselwege lässt sich über allosterische Enzyme kontrollieren. Dabei bestimmt die Konzentration eines Substrates oder Produktes die Aktivität der Enzymkette. Die Regulation verhindert somit einen übermäßigen Auf- bzw. Abbau von Molekülen. Ökonomie ist alles.
Wie das funktioniert, wird auf dieser Seite besprochen.
Allosterischer Effekt
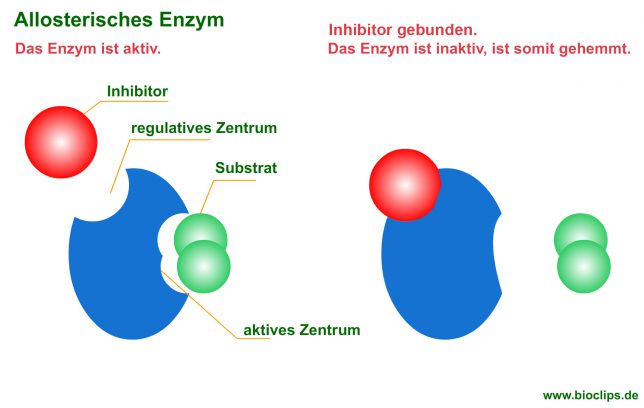
- Allosterische Enzyme verfügen über ein aktives und ein regulatives Zentrum.
- Im aktiven Zentrum wird das Substrat gebunden und umgesetzt.
- Im regulativen Zentrum bindet der sogenannte Effektor. Der Effektor kann das Enzym hemmen oder aktivieren.
- Die Abbildung zeigt als Effektor einen Inhibitor der das Enzym hemmt.
Hemmung der Enzymaktivität
Wirkt der Effektor hemmend (Effektor = Inhibitor ), dann verändert der Inhibitor die räumliche Struktur des Enzyms, so daß das Substrat nicht mehr im aktiven Zentrum binden kann.
Aktivierung der Enzymaktivität
Aktiviert der Effektor das Enzym (Effektor = Aktivator), so verändert sich durch die Bindung des Aktivators die räumliche Struktur des Enzyms, so daß das Substrat binden kann.
![]() Auf dem Lernpfad
Auf dem Lernpfad
